Í nútímalæknisfræði hafa sýklalyf reynst ein mikilvægasta framfarin og lækkað verulega tíðni og dánartíðni af völdum örverusýkinga. Hæfni þeirra til að breyta klínískum útkomum bakteríusýkinga hefur lengt lífslíkur ótal sjúklinga. Sýklalyf eru mikilvæg í flóknum læknisfræðilegum aðgerðum, þar á meðal skurðaðgerðum, ígræðslum, ígræðslum og krabbameinslyfjameðferð. Hins vegar hefur tilkoma sýklalyfjaónæmra sýkla verið vaxandi áhyggjuefni og dregið úr virkni þessara lyfja með tímanum. Tilfelli af sýklalyfjaónæmi hafa verið skráð í öllum flokkum sýklalyfja þegar stökkbreytingar eiga sér stað í örverum. Úrvalsþrýstingur frá sýklalyfjum hefur stuðlað að aukningu ónæmra stofna, sem er veruleg áskorun fyrir heilsu heimsins.
Til að berjast gegn hinu brýna vandamáli sem sýklalyfjaónæmi veldur er nauðsynlegt að innleiða árangursríkar stefnur í sýkingavörnum sem draga úr útbreiðslu ónæmra sýkla, ásamt því að draga úr notkun sýklalyfja. Ennfremur er brýn þörf fyrir aðrar meðferðaraðferðir. Súrefnismeðferð með ofanþrýstingi (HBOT) hefur komið fram sem efnileg aðferð í þessu samhengi og felur í sér innöndun 100% súrefnis við ákveðinn þrýsting í ákveðinn tíma. HBOT, sem er annað hvort aðal- eða viðbótarmeðferð við sýkingum, gæti veitt nýjar vonir í meðferð bráðra sýkinga af völdum sýklalyfjaónæmra sýkla.
Þessi meðferð er í auknum mæli notuð sem aðalmeðferð eða valkostur við ýmsum sjúkdómum, þar á meðal bólgu, kolmónoxíðeitrun, langvinnum sárum, blóðþurrðarsjúkdómum og sýkingum. Klínísk notkun HBOT í sýkingameðferð er mikil og veitir sjúklingum ómetanlegan ávinning.

Klínísk notkun súrefnismeðferðar með ofurþrýstingi við sýkingum
Núverandi rannsóknir styðja sterklega notkun HBOT, bæði sem sjálfstæðrar meðferðar og viðbótarmeðferðar, og veita sýktum sjúklingum verulegan ávinning. Meðan á HBOT stendur getur súrefnisþrýstingur í slagæðum blóðs hækkað í 2000 mmHg og mikill súrefnis-vefjaþrýstingshalla sem af því hlýst getur hækkað súrefnisgildi í vefjum í 500 mmHg. Slík áhrif eru sérstaklega mikilvæg til að stuðla að græðslu bólgusvörunar og truflana á örblóðrás sem sjást í blóðþurrðarumhverfi, sem og við meðhöndlun hólfheilkennis.
HBOT getur einnig haft áhrif á ástand sem eru háð ónæmiskerfinu. Rannsóknir benda til þess að HBOT geti bælt sjálfsofnæmisheilkenni og mótefnavakaframkallað ónæmissvörun, sem hjálpar til við að viðhalda þoli ígræðslu með því að draga úr blóðrás eitilfrumna og hvítfrumna og jafnframt stjórna ónæmissvörun. Að auki getur HBOTstyður við lækninguí langvinnum húðskemmdum með því að örva æðamyndun, sem er mikilvægt ferli fyrir bættan bata. Þessi meðferð hvetur einnig til myndunar kollagenmatrix, sem er nauðsynlegt stig í sárgræðslu.
Sérstaklega þarf að huga að ákveðnum sýkingum, sérstaklega djúpum og erfiðum meðferðarsýkingum eins og drepbólgu í fasci, beinbólgu, langvinnum mjúkvefjasýkingum og smitandi hjartaþelsbólgu. Ein algengasta klíníska notkun HBOT er við sýkingum í húð og mjúkvef og beinbólgu sem tengist lágu súrefnisgildi sem oft eru af völdum loftfirrtra eða ónæmra baktería.
1. Sýkingar í fótum af völdum sykursýki
SykursýkisfóturSár eru algengur fylgikvilli hjá sykursjúkum og hafa áhrif á allt að 25% af þessum hópi. Sýkingar koma oft upp í þessum sárum (sem eru 40%-80% tilfella) og leiða til aukinnar sjúkdómstíðni og dánartíðni. Fótarsýkingar af völdum sykursýki samanstanda venjulega af fjölörverusýkingum þar sem fjölbreytt úrval af loftfirrtum bakteríum hefur verið greint. Ýmsir þættir, þar á meðal gallar í bandvefsfrumustarfsemi, vandamál með myndun kollagens, ónæmiskerfi frumna og starfsemi átfrumna, geta hindrað sárgræðslu hjá sykursjúkum. Nokkrar rannsóknir hafa bent á skerta súrefnismettun húðarinnar sem sterkan áhættuþátt fyrir aflimanir tengdar fótarsýkingum.
Sem einn af núverandi valkostum við meðferð við sjúkdómsvaldandi blöðruskemmdumGreint hefur verið frá því að HBOT auki verulega græðsluhraða fótasára af völdum sykursýki og minnki þar með þörfina fyrir aflimanir og flóknar skurðaðgerðir. Það lágmarkar ekki aðeins þörfina fyrir úrræðafrekar aðgerðir, svo sem laskaaðgerðir og húðígræðslur, heldur hefur það einnig lægri kostnað og lágmarkar aukaverkanir samanborið við skurðaðgerðir. Rannsókn eftir Chen o.fl. sýndi að fleiri en 10 lotur af HBOT leiddu til 78,3% bættrar græðsluhraða sára hjá sykursjúklingum.
2. Drepmyndandi mjúkvefssýkingar
Mjúkvefssýkingar sem valda drepi (NSTI) eru oft fjölörvera, oftast af völdum blöndu af loftháðum og loftfirrtum bakteríum og tengjast oft loftmyndun. Þótt NSTI séu tiltölulega sjaldgæfar eru dánartíðni þeirra há vegna hraðrar framvindu. Tímabær og viðeigandi greining og meðferð eru lykillinn að því að ná jákvæðum árangri og HBOT hefur verið mælt með sem viðbótarmeðferð við meðhöndlun NSTI. Þótt enn séu deilur um notkun HBOT við NSTI vegna skorts á framsýnum samanburðarrannsóknum,Vísbendingar benda til þess að þetta gæti tengst bættri lifunartíðni og varðveislu líffæra hjá sjúklingum með NSTIAfturskyggn rannsókn benti til marktækrar lækkunar á dánartíðni meðal sjúklinga með NSTI sem fengu HBOT.
1.3 Sýkingar á skurðstað
Hægt er að flokka sýkingar í sýklum (SSI) eftir staðsetningu sýkingarinnar og geta stafað af ýmsum sýklum, þar á meðal bæði loftháðum og loftfirrtum bakteríum. Þrátt fyrir framfarir í sóttvarnaaðgerðum, svo sem sótthreinsunartækni, notkun fyrirbyggjandi sýklalyfja og úrbætur í skurðaðgerðum, eru SSI enn viðvarandi fylgikvilli.
Ein mikilvæg yfirlitsgrein hefur rannsakað virkni lifrarbólgumeðferðar (HBOT) við að koma í veg fyrir djúpar sýkingar í sárvef (SSI) í skurðaðgerðum vegna taugavöðvahryggskekkju. HBOT fyrir aðgerð getur dregið verulega úr tíðni SSI-sýkinga og auðveldað sárgræðslu. Þessi óinngripsmeðferð skapar umhverfi þar sem súrefnismagn í sárvefjum er hækkað, sem hefur verið tengt oxunaráhrifum gegn sýklum. Að auki tekur hún á lækkuðu blóð- og súrefnismagni sem stuðlar að þróun SSI-sýkinga. Auk annarra aðferða til að stjórna sýkingum hefur HBOT verið mælt með sérstaklega fyrir skurðaðgerðir með hreina mengun, svo sem ristil- og endaþarmaaðgerðir.
1.4 Brunasár
Brunasár eru meiðsli af völdum mikils hita, rafstraums, efna eða geislunar og geta valdið mikilli sjúkdóms- og dánartíðni. HBOT er gagnlegt við meðferð bruna með því að auka súrefnismagn í skemmdum vefjum. Þó að dýrarannsóknir og klínískar rannsóknir sýni misvísandi niðurstöður varðandi...Virkni HBOT við brunameðferð, rannsókn sem náði til 125 brunasjúklinga benti til þess að lifrarbólga með blóðsýkingu (HBOT) hefði engin marktæk áhrif á dánartíðni eða fjölda aðgerða en hefði stytt meðalgræðslutíma (19,7 dagar samanborið við 43,8 daga). Með því að samþætta HBOT við alhliða brunameðferð gæti verið hægt að stjórna blóðsýkingu á áhrifaríkan hátt hjá brunasjúklingum, sem leiðir til styttri græðslutíma og minni vökvaþarfar. Hins vegar er þörf á frekari ítarlegum, framsýnum rannsóknum til að staðfesta hlutverk HBOT í meðferð umfangsmikilla bruna.
1.5 Beinbólga
Beinbólga er sýking í beinum eða beinmerg, oft af völdum baktería. Meðferð við beinbólgu getur verið krefjandi vegna tiltölulega lélegs blóðflæðis til beina og takmarkaðs magns sýklalyfja í beinmerginn. Langvinn beinbólga einkennist af viðvarandi sýklum, vægri bólgu og myndun dreps í beinvef. Þrálát beinbólga vísar til langvinnra sýkinga í beinum sem halda áfram eða koma aftur þrátt fyrir viðeigandi meðferð.
HBOT hefur reynst bæta súrefnismagn í sýktum beinvef verulega. Fjölmargar rannsóknir og hóprannsóknir benda til þess að HBOT bæti klínísk áhrif hjá sjúklingum með beinbólgu. Það virðist virka með ýmsum aðferðum, þar á meðal að auka efnaskiptavirkni, bæla bakteríusýkingar, auka áhrif sýklalyfja, lágmarka bólgu og stuðla að græðslu.Eftir lifrarbólgu sýna 60% til 85% sjúklinga með langvinna, þráláta beinbólgu merki um sýkingarbælingu.
1.6 Sveppasýkingar
Um allan heim þjást yfir þrjár milljónir einstaklinga af langvinnum eða ífarandi sveppasýkingum, sem leiðir til yfir 600.000 dauðsfalla árlega. Meðferðarárangur sveppasýkinga er oft skertur vegna þátta eins og breytts ónæmisstöðu, undirliggjandi sjúkdóma og eiturvirkni sýkla. HBOT er að verða aðlaðandi meðferðarvalkostur við alvarlegum sveppasýkingum vegna öryggis þess og óífarandi eðlis. Rannsóknir benda til þess að HBOT geti verið áhrifaríkt gegn sveppasýkingum eins og Aspergillus og Mycobacterium tuberculosis.
HBOT stuðlar að sveppaeyðandi áhrifum með því að hindra myndun líffilmu Aspergillus, með aukinni virkni sem sést í stofnum sem skortir superoxide dismutasa (SOD) gen. Súrefnisskortur við sveppasýkingar skapar áskoranir fyrir afhendingu sveppalyfja, sem gerir aukið súrefnismagn frá HBOT að hugsanlega gagnlegri íhlutun, þó frekari rannsókna sé þörf.
Örverueyðandi eiginleikar HBOT
Hið ofuroxíska umhverfi sem HBOT skapar hrinda af stað lífeðlisfræðilegum og lífefnafræðilegum breytingum sem örva bakteríudrepandi eiginleika, sem gerir það að áhrifaríkri viðbótarmeðferð við sýkingum. HBOT sýnir fram á merkileg áhrif gegn loftháðum bakteríum og aðallega loftfirrtum bakteríum með ferlum eins og beinum bakteríudrepandi virkni, aukinni ónæmissvörun og samverkandi áhrifum með ákveðnum sýklalyfjum.
2.1 Bein áhrif HBOT á bakteríur
Bein bakteríudrepandi áhrif HBOT eru að miklu leyti rakin til myndunar hvarfgjarnra súrefnistegunda (ROS), þar á meðal súperoxíðanjóna, vetnisperoxíð, hýdroxýl stakeindir og hýdroxýljóna — sem öll myndast við frumuefnaskipti.
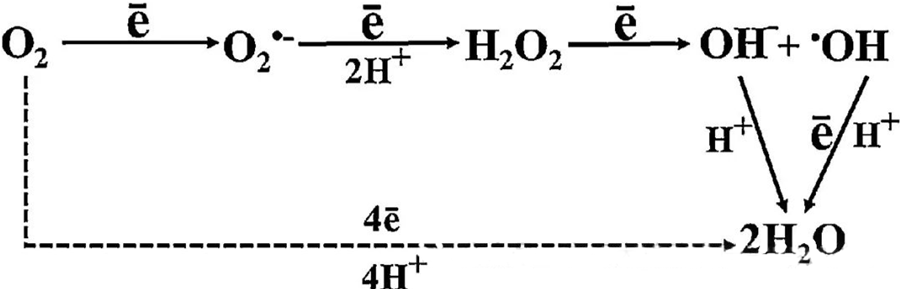
Samspil O₂ og frumuefna er nauðsynlegt til að skilja hvernig ROS myndast í frumum. Við ákveðnar aðstæður, sem kallast oxunarálag, raskast jafnvægið milli myndunar ROS og niðurbrots þeirra, sem leiðir til hækkaðs magns ROS í frumum. Framleiðsla á ofuroxíði (O₂⁻) er hvötuð af ofuroxíð dismutasa, sem síðan breytir O₂⁻ í vetnisperoxíð (H₂O₂). Þessi umbreyting er enn frekar magnað með Fenton-viðbrögðum, sem oxar Fe²⁺ til að mynda hýdroxýl stakeindir (·OH) og Fe³⁺, og þannig hefjast skaðleg oxunar-afoxunarröð ROS myndunar og frumuskemmda.
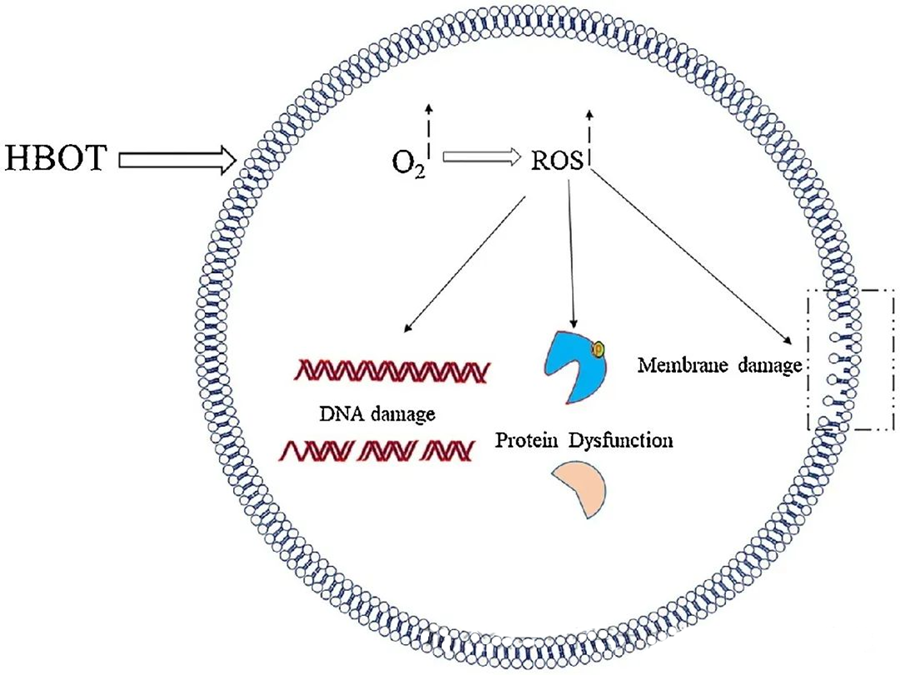
Eituráhrif ROS beinast að mikilvægum frumuþáttum eins og DNA, RNA, próteinum og lípíðum. Athyglisvert er að DNA er aðalmarkmið H₂O₂-miðlaðra frumueituráhrifa, þar sem það raskar deoxýríbósabyggingu og skemmir basasamsetningu. Líkamleg skaði af völdum ROS nær til helixbyggingar DNA, hugsanlega vegna lípíðperoxíðunar sem ROS veldur. Þetta undirstrikar skaðlegar afleiðingar hækkaðs ROS-gildis innan líffræðilegra kerfa.
Örverueyðandi áhrif ROS
ROS gegna mikilvægu hlutverki í að hindra örveruvöxt, eins og sést á ROS myndun sem HBOT veldur. Eituráhrif ROS beinast beint að frumuefnum eins og DNA, próteinum og lípíðum. Hár styrkur virkra súrefnistegunda getur skemmt lípíði beint, sem leiðir til fituperoxíðunar. Þetta ferli hefur áhrif á heilleika frumuhimna og þar af leiðandi virkni himnutengdra viðtaka og próteina.
Þar að auki gangast prótein, sem einnig eru mikilvæg sameindamarkmið ROS, undir sérstakar oxunarbreytingar á ýmsum amínósýruleifum eins og cysteini, metíóníni, týrósíni, fenýlalaníni og tryptófani. Til dæmis hefur verið sýnt fram á að HBOT veldur oxunarbreytingum í nokkrum próteinum í E. coli, þar á meðal lengingarþætti G og DnaK, og hefur þannig áhrif á frumustarfsemi þeirra.
Að efla ónæmi með HBOT
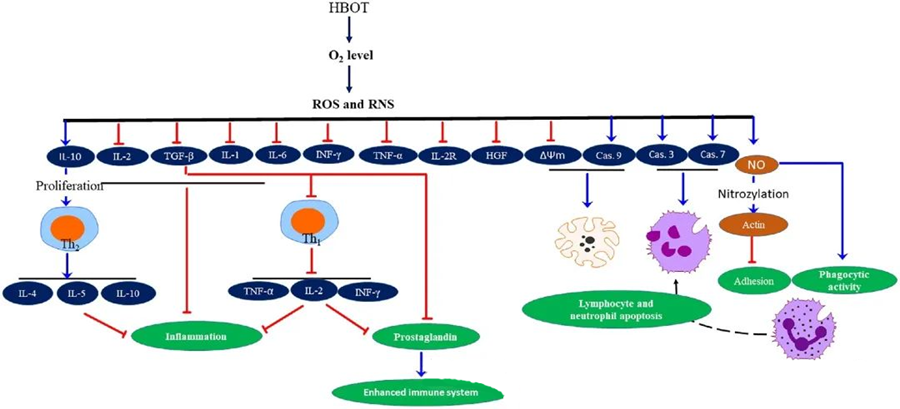
Bólgueyðandi eiginleikar HBOThafa verið skjalfestar, sem hafa reynst mikilvæg til að draga úr vefjaskemmdum og bæla framgang sýkinga. HBOT hefur veruleg áhrif á tjáningu frumuboða og annarra bólguvaldandi efna og hefur þannig áhrif á ónæmissvörun. Ýmsar tilraunakerfi komust að mismunandi breytingum á genatjáningu og próteinmyndun eftir HBOT, sem annað hvort auka eða minnka vaxtarþætti og frumuboðefni.
Meðan á HBOT ferlinu stendur veldur aukið O₂ gildi ýmsum frumuviðbrögðum, svo sem að bæla losun bólguvaldandi miðlara og stuðla að frumudauða eitilfrumna og daufkyrninga. Samanlagt styrkja þessir eiginleikar örverueyðandi verkun ónæmiskerfisins og auðvelda þannig græðslu sýkinga.
Ennfremur benda rannsóknir til þess að aukið O₂ gildi meðan á HBOT stendur geti dregið úr tjáningu bólguvaldandi frumuboða, þar á meðal interferon-gamma (IFN-γ), interleukin-1 (IL-1) og interleukin-6 (IL-6). Þessar breytingar fela einnig í sér niðurstýringu á hlutfalli CD4:CD8 T-frumna og stjórnun á öðrum leysanlegum viðtökum, sem að lokum hækkar interleukin-10 (IL-10) gildi, sem er mikilvægt til að vinna gegn bólgu og stuðla að græðslu.
Örverueyðandi virkni HBOT er samofin flóknum líffræðilegum ferlum. Greint hefur verið frá því að bæði súrefnisoxíð og hækkaður þrýstingur stuðli ósamræmið að bakteríudrepandi virkni HBOT og frumudauða hvítra blóðkorna. Eftir HBOT eykur mikil hækkun á súrefnisgildum bakteríudrepandi getu hvítra blóðkorna, sem er nauðsynlegur þáttur í ónæmissvöruninni. Ennfremur bælir HBOT niður viðloðun hvítra blóðkorna, sem er miðluð af víxlverkun β-integrína á hvítra blóðkorna við millifrumuviðloðunarsameindir (ICAM) á æðaþelsfrumum. HBOT hamlar virkni hvítra blóðkorna β-2 integríns (Mac-1, CD11b/CD18) í gegnum ferli sem miðlað er af nituroxíði (NO), sem stuðlar að flutningi hvítra blóðkorna á sýkingarstað.
Nákvæm endurröðun frumugrindarinnar er nauðsynleg til þess að daufkyrningar geti ávirkað sýkla. Sýnt hefur verið fram á að S-nítrósýlering aktíns örvar fjölliðun aktíns, sem hugsanlega auðveldar átfrumuvirkni daufkyrninga eftir formeðferð með HBOT. Ennfremur stuðlar HBOT að stýrðum frumudauða í T-frumulínum manna í gegnum hvatberaleiðir, og greint hefur verið frá hraðari eitilfrumudauða eftir HBOT. Sýnt hefur verið fram á ónæmisstýrandi áhrif HBOT með því að hindra kaspasa-9 - án þess að hafa áhrif á kaspasa-8.
Samverkandi áhrif HBOT með örverueyðandi efnum
Í klínískum tilgangi er HBOT oft notað samhliða sýklalyfjum til að berjast gegn sýkingum á áhrifaríkan hátt. Sú súrefnisuppsöfnun sem næst við HBOT getur haft áhrif á virkni ákveðinna sýklalyfja. Rannsóknir benda til þess að ákveðin bakteríudrepandi lyf, svo sem β-laktam, flúorókínólón og amínóglýkósíð, virki ekki aðeins með meðfæddum ferlum heldur reiða sig einnig að hluta til á loftháð efnaskipti baktería. Þess vegna eru nærvera súrefnis og efnaskiptaeiginleikar sýkla lykilatriði þegar meðferðaráhrif sýklalyfja eru metin.
Marktækar vísbendingar hafa sýnt að lágt súrefnismagn getur aukið viðnám Pseudomonas aeruginosa gegn píperacillíni/tazobactam og að súrefnissnautt umhverfi stuðlar einnig að auknu viðnámi Enterobacter cloacae gegn azithromycini. Aftur á móti geta ákveðin súrefnisskortsástand aukið næmi baktería fyrir tetracycline sýklalyfjum. HBOT þjónar sem nothæf viðbótarmeðferð með því að örva loftháð efnaskipti og endursúrefnisfæða sýkta vefi með súrefnisskorti, sem eykur síðan næmi sýkla fyrir sýklalyfjum.
Í forklínískum rannsóknum minnkaði samsetning HBOT – gefið tvisvar á dag í 8 klukkustundir við 280 kPa – ásamt tobramycini (20 mg/kg/dag) verulega bakteríumagn í smitandi hjartaþelsbólgu af völdum Staphylococcus aureus. Þetta sýnir fram á möguleika HBOT sem viðbótarmeðferðar. Frekari rannsóknir hafa leitt í ljós að við 37°C og 3 ATA þrýsting í 5 klukkustundir jók HBOT verulega áhrif imipenems gegn átfrumusýktum Pseudomonas aeruginosa. Að auki reyndist samsetning HBOT og cefazólíns vera áhrifaríkari við meðferð á beinbólgu af völdum Staphylococcus aureus í dýralíkönum samanborið við cefazólín eitt sér.
HBOT eykur einnig verulega bakteríudrepandi áhrif cíprófloxasíns gegn lífhimnum Pseudomonas aeruginosa, sérstaklega eftir 90 mínútna útsetningu. Þessi aukning er rakin til myndunar innrænna hvarfgjarnra súrefnistegunda (ROS) og sýnir aukna næmi í peroxidasa-gölluðum stökkbreytingum.
Í líkönum af fleiðrubólgu af völdum methicillin-ónæmra Staphylococcus aureus (MRSA), sýndi samverkandi áhrif vankómýsíns, teikoplaníns og línezólíðs með HBOT marktækt aukna virkni gegn MRSA. Metronídasól, sýklalyf sem er mikið notað við meðferð alvarlegra loftfirrtra og fjölörvera sýkinga eins og fótasýkinga af völdum sykursýki og sýkinga á skurðsvæðum, hefur sýnt meiri örverueyðandi virkni við loftfirrtar aðstæður. Framtíðarrannsóknir eru réttlætanlegar til að kanna samverkandi bakteríudrepandi áhrif HBOT í samsetningu við metronídasól, bæði in vivo og in vitro.
Sýklalyfjaáhrif HBOT á ónæmar bakteríur
Með þróun og útbreiðslu ónæmra stofna missa hefðbundin sýklalyf oft virkni sína með tímanum. Þar að auki getur HBOT reynst nauðsynlegt við meðferð og forvarnir gegn sýkingum af völdum fjölónæmra sýkla og þjónað sem mikilvæg stefna þegar sýklalyfjameðferð bregst. Fjölmargar rannsóknir hafa greint frá verulegum bakteríudrepandi áhrifum HBOT á klínískt mikilvægar ónæmar bakteríur. Til dæmis dró 90 mínútna HBOT lota við 2 ATM verulega úr vexti MRSA. Að auki hefur HBOT, í hlutfallslíkönum, aukið bakteríudrepandi áhrif ýmissa sýklalyfja gegn MRSA sýkingum. Skýrslur hafa staðfest að HBOT er áhrifaríkt við meðferð á beinbólgu af völdum OXA-48-framleiðandi Klebsiella pneumoniae án þess að þörf sé á viðbótar sýklalyfjum.
Í stuttu máli er súrefnismeðferð með ofurþrýstingi fjölþætt nálgun á sýkingastjórnun, sem eykur ónæmissvörun og eykur jafnframt virkni núverandi sýklalyfja. Með ítarlegri rannsóknum og þróun hefur hún möguleika á að draga úr áhrifum sýklalyfjaónæmis og veitir von í áframhaldandi baráttunni gegn bakteríusýkingum.
Birtingartími: 28. febrúar 2025

